- A
- A
- A
キューブパズルに着想を得たフォールディング論文(by 郷信広博士)
今回はごく最近出版された論文紹介をしたい。内容は、本ブログで何度も登場しているキューブパズルに着想を得た本格的な蛋白質フォールディングの論考で、著者は郷信広京大名誉教授の単著である。
Snake cube puzzle and protein folding
Nobuhiro Go
Biophysics and Physicobiology, Vol. 16, pp. 256–263 (2019)
doi: 10.2142/biophysico.16.0_256 (無料でpdfダウンロード)
日本の生物物理のパイオニアのお一人で蛋白質フォールディングのシミュレーションの世界的な先達である郷先生の論文はどんな内容なのか。論文を紹介する前にいくつか背景を書いておこう。(パズルのことと郷先生の功績をよく知っている方は飛ばして下へ)
【背景1:キューブパズル】
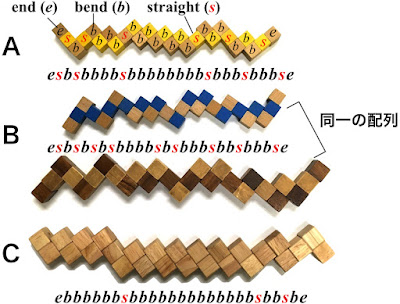
キューブパズルは27個のパーツを折りたたんでコンパクトな3×3×3の立方体に戻すパズルである。パズルをばらすとヘビみたいなのでスネークパズルとかコブラパズルとか呼ばれることもある。蛋白質に見立てると、ヘビの状態でくねくねといろんなカタチを取り得るところが蛋白質の変性状態に似ている。このヘビを折りたたんで3×3×3のキューブにした構造が蛋白質でいう天然構造である。
 最後にキューブになるのはどれも同じだが、経路はいろんなバリエーションが売っている。私のコレクションは10種類ほどあるが(注1)、そのいくつかの「変性」状態と「天然」構造を写真にて紹介する。
最後にキューブになるのはどれも同じだが、経路はいろんなバリエーションが売っている。私のコレクションは10種類ほどあるが(注1)、そのいくつかの「変性」状態と「天然」構造を写真にて紹介する。
#ブログでの紹介例
経路の違うフォールディングパズル(2010年12月)
新規フォールディング経路のキューブパズル(2018年9月)
【背景2:蛋白質フォールディングの整合性原理とGo(郷)モデル】
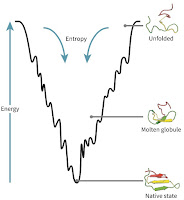
蛋白質の立体構造形成、すなわちフォールディング(折りたたみ)の基本は、アミノ酸配列さえ決まれば蛋白質の立体構造は一義に決まる、というものである(Anfinsenのドグマと呼ばれる)。別の言い方をすると、蛋白質フォールディング反応は自発的、熱力学的に言えば、ギブズの自由エネルギー(ΔG)が負ということである。これを概念的に図示する場合、よく使われるのが右に示すようなフォールディングのエネルギー地形で、フォールディングをファネル(漏斗)に例える。この「漏斗」の上方はさまざまな変性状態が集まっていてエントロピーが大きい状態で、下へ落ちるにしたがって少しずつΔGが小さくなっていく(図の上ほどエネルギー大)。最終的にΔGが最小になったところ(漏斗の一番下のとんがった部分)でフォールディングは完了して天然構造となる。
このファネル理論は米国の研究者たちが1990年代に使い出したものだが、その源流に郷先生が1983年に提唱した「整合性原理(consistency principle)」があり、Go(郷)モデルと呼ばれることもある。整合性原理は「タンパク質は天然構造において2次構造と3次構造すべての相互作用が整合して全体を安定化している」という考え方である(この原理の解説を多数著している京大理学研究科の高田彰二さんの表現:注2)。要は、漏斗のどこでも下へ向かって落ちていって最終的に一番下の天然構造に向かっていくということとも言える。
【論文の内容紹介】
前置きが長くなったが、今回紹介する郷先生の論文は日本生物物理学会が刊行している「Biophysics and Physicobiology」誌の郷先生80歳記念の特集に郷先生自らが寄稿したフォールディングに関する論考である。
ざっくりと言えば、このパズルでの27個のパーツをどのような「配列」にしたときに、3×3×3の立方体にフォールディング可能か、また、そこから出発して、このパズルに「疎水性相互作用」を導入するなどして、蛋白質らしさの本質とは何かを考察している。
「配列」と言っても20種類のアミノ酸が並ぶ配列ではない。その説明のために図解を付けてみる。
先にも見せたキューブパズルは同じ配列ではない。黄色(A)、青色(その下の濃淡の茶色も同じ配列:B)、薄い茶色(C)の三種類は並び方が違うのがわかるだろうか。
例として、黄色(A)で説明する。27個のパーツの末端2つを e (end)、内部の25個は折れ曲がる部分をb(bend)もしくは3つ直線に並ぶ真ん中をs(straight)と定義する。この場合、黄色パズル(A)の「配列」は
となる(注3)。
こう考えると、eは置き場所が決まっていて、内部の25個で b か s の2通りがあり得るので、配列の場合の数はトータルで2の25乗(3300万種類ほど)となる。
この総数の中で3×3×3のキューブ型に折りたたむことが可能な「配列」を全て計算で求めたところ、22,897種であった。つまり、あり得る配列空間の中のたった約0.07%(=22,897/2の25乗)のみが折りたたみできる、ということである。
この中には(3×3×3のキューブ型にはなるものの)複数の折りたたみ構造をもつ配列も多数あるが、7,268種の配列はその折りたたみ構造が特異的(ユニーク)であった。写真の3種類はいずれもユニークな配列だった。(私の感想としては、このキューブパズルで商品化されている「構造」はごくごくわずかであると言えよう)。
実はこの辺りの論考は既に世界のパズルマニアが似たような計算をしているということだ(例えば Jaap’s Puzzle Pages)。そこで、郷先生はパズルをより蛋白質らしくしていく。このスネークパズルは幾何学的に3×3×3を実現するという点でファンデルワールス(van der waals: VdW)力をベースにしているとも言えるが、それとは別に疎水相互作用(hydrophobic interaction)を導入したHPパズル、さらにHPパズルとファンデルワールスを組み合わせた複合(compound)パズルを考案して、これらのパズルの蛋白質らしさについて議論している。実際の蛋白質は20種類のアミノ酸が数百、数千並んで複雑な立体構造になるが、ここで示したように単純なモデルにすることで、蛋白質とは何かという本質を抽出した論文であると言えよう。途中、郷先生自らによる整合性原理の解説も含まれている。
興味をもった方は論文pdfをダウンロード(無料)してぜひ読んでほしい。
さて、ここからは余談である。この論文はつい最近、今年秋に公開されたが、実は2年ほど前に郷先生がこのような論考をしていることを知った。私は2002~2006年までJSTさきがけ研究者に採択いただいたが、その際の研究総括が郷先生であった(「生体分子の形と機能」領域)。その領域の同窓会が2年前に開催され(注4)、それぞれの近況を短い時間で話す機会があり、そこで郷先生自らが発表したのがこの論文の原型となる内容だった。フォールディング理論のパイオニアの郷先生自らがキューブパズルに着想を得て話しはじめたのだから聴き始めた私が驚いて鳥肌が立ったのは言うまでもない。しかも、キューブパズルは東寺のがらくた市で見つけて入手したということでなお嬉しくなった(注5)。
その同窓会での私の発表でもイントロでキューブパズルを使っていたこともあり、郷先生に、私のブログでさまざまな経路のパズルを紹介しています、と伝えていた。その際にお教えした3種類の経路のパズル(上記のパズルA~C)が、今回の論文の中でユニークな配列の例として実際に使われている。つまり、私自身もこの論文に少し影響を与えたというのは実に光栄なことである。
以上、このように複雑な事象を単純化して本質を抽出し、さらにそこから複雑な事象に洞察を与える、という研究を自らも進めてみたい。
注1:経路が別々のものや4×4×4の超難解なものをそこそこもっているだけではない。ラボには青色パズル(B)と同じ経路のものが教材として160個程度ある。東工大1年生向けに蛋白質フォールディング入門のような講義を担当しており、その際に生命理工学院1年生全員(150名程度)に一人一個ずつ配布してパズルで遊んでもらって蛋白質フォールディングの難しさを実感してもらっているのだ。10~15分ほどフォールディングにトライしてもらう(遊んでもらう)。「シャペロン」となってフォールディングを完成させる学生は1割に満たない。
注2:高田彰二「郷モデルの35年」 (生物物理 50(4),158-159,2010)に非常にわかりやすい解説がある。→無料pdfダウンロード
注3:ちなみにこのbが多いほど、すなわち折れ曲がりの数が多いほどパズルは一般に難解になる。すなわち、この三つの中で最も難しいパズルがC、最も簡単なのはBである。
注4:さきがけ研究の良かった一つは、同世代の関連研究者、領域総括を含めたシニア研究者(アドバイザー)が合宿形式で切磋琢磨するところだ。研究分野はそれほど近すぎないのもよかったし、領域終了後も貴重なネットワークとなっている。
注5:東寺と言えば、その紋がシャペロニンGroELそっくり、ということで以前ブログに登場してもらった(→東寺の紋とシャペロニン)。
東寺はなんとフォールディングに関係することか!
Snake cube puzzle and protein folding
Nobuhiro Go
Biophysics and Physicobiology, Vol. 16, pp. 256–263 (2019)
doi: 10.2142/biophysico.16.0_256 (無料でpdfダウンロード)
日本の生物物理のパイオニアのお一人で蛋白質フォールディングのシミュレーションの世界的な先達である郷先生の論文はどんな内容なのか。論文を紹介する前にいくつか背景を書いておこう。(パズルのことと郷先生の功績をよく知っている方は飛ばして下へ)
 |
| スネークキューブパズル |
キューブパズルは27個のパーツを折りたたんでコンパクトな3×3×3の立方体に戻すパズルである。パズルをばらすとヘビみたいなのでスネークパズルとかコブラパズルとか呼ばれることもある。蛋白質に見立てると、ヘビの状態でくねくねといろんなカタチを取り得るところが蛋白質の変性状態に似ている。このヘビを折りたたんで3×3×3のキューブにした構造が蛋白質でいう天然構造である。
 最後にキューブになるのはどれも同じだが、経路はいろんなバリエーションが売っている。私のコレクションは10種類ほどあるが(注1)、そのいくつかの「変性」状態と「天然」構造を写真にて紹介する。
最後にキューブになるのはどれも同じだが、経路はいろんなバリエーションが売っている。私のコレクションは10種類ほどあるが(注1)、そのいくつかの「変性」状態と「天然」構造を写真にて紹介する。#ブログでの紹介例
経路の違うフォールディングパズル(2010年12月)
新規フォールディング経路のキューブパズル(2018年9月)
【背景2:蛋白質フォールディングの整合性原理とGo(郷)モデル】
 |
| Wikipedia(folding funnel)より |
このファネル理論は米国の研究者たちが1990年代に使い出したものだが、その源流に郷先生が1983年に提唱した「整合性原理(consistency principle)」があり、Go(郷)モデルと呼ばれることもある。整合性原理は「タンパク質は天然構造において2次構造と3次構造すべての相互作用が整合して全体を安定化している」という考え方である(この原理の解説を多数著している京大理学研究科の高田彰二さんの表現:注2)。要は、漏斗のどこでも下へ向かって落ちていって最終的に一番下の天然構造に向かっていくということとも言える。
【論文の内容紹介】
前置きが長くなったが、今回紹介する郷先生の論文は日本生物物理学会が刊行している「Biophysics and Physicobiology」誌の郷先生80歳記念の特集に郷先生自らが寄稿したフォールディングに関する論考である。
ざっくりと言えば、このパズルでの27個のパーツをどのような「配列」にしたときに、3×3×3の立方体にフォールディング可能か、また、そこから出発して、このパズルに「疎水性相互作用」を導入するなどして、蛋白質らしさの本質とは何かを考察している。
「配列」と言っても20種類のアミノ酸が並ぶ配列ではない。その説明のために図解を付けてみる。
先にも見せたキューブパズルは同じ配列ではない。黄色(A)、青色(その下の濃淡の茶色も同じ配列:B)、薄い茶色(C)の三種類は並び方が違うのがわかるだろうか。
例として、黄色(A)で説明する。27個のパーツの末端2つを e (end)、内部の25個は折れ曲がる部分をb(bend)もしくは3つ直線に並ぶ真ん中をs(straight)と定義する。この場合、黄色パズル(A)の「配列」は
esbsbbbbsbbbbbbbbsbbbsbbbse
となる(注3)。
こう考えると、eは置き場所が決まっていて、内部の25個で b か s の2通りがあり得るので、配列の場合の数はトータルで2の25乗(3300万種類ほど)となる。
この総数の中で3×3×3のキューブ型に折りたたむことが可能な「配列」を全て計算で求めたところ、22,897種であった。つまり、あり得る配列空間の中のたった約0.07%(=22,897/2の25乗)のみが折りたたみできる、ということである。
この中には(3×3×3のキューブ型にはなるものの)複数の折りたたみ構造をもつ配列も多数あるが、7,268種の配列はその折りたたみ構造が特異的(ユニーク)であった。写真の3種類はいずれもユニークな配列だった。(私の感想としては、このキューブパズルで商品化されている「構造」はごくごくわずかであると言えよう)。
実はこの辺りの論考は既に世界のパズルマニアが似たような計算をしているということだ(例えば Jaap’s Puzzle Pages)。そこで、郷先生はパズルをより蛋白質らしくしていく。このスネークパズルは幾何学的に3×3×3を実現するという点でファンデルワールス(van der waals: VdW)力をベースにしているとも言えるが、それとは別に疎水相互作用(hydrophobic interaction)を導入したHPパズル、さらにHPパズルとファンデルワールスを組み合わせた複合(compound)パズルを考案して、これらのパズルの蛋白質らしさについて議論している。実際の蛋白質は20種類のアミノ酸が数百、数千並んで複雑な立体構造になるが、ここで示したように単純なモデルにすることで、蛋白質とは何かという本質を抽出した論文であると言えよう。途中、郷先生自らによる整合性原理の解説も含まれている。
興味をもった方は論文pdfをダウンロード(無料)してぜひ読んでほしい。
さて、ここからは余談である。この論文はつい最近、今年秋に公開されたが、実は2年ほど前に郷先生がこのような論考をしていることを知った。私は2002~2006年までJSTさきがけ研究者に採択いただいたが、その際の研究総括が郷先生であった(「生体分子の形と機能」領域)。その領域の同窓会が2年前に開催され(注4)、それぞれの近況を短い時間で話す機会があり、そこで郷先生自らが発表したのがこの論文の原型となる内容だった。フォールディング理論のパイオニアの郷先生自らがキューブパズルに着想を得て話しはじめたのだから聴き始めた私が驚いて鳥肌が立ったのは言うまでもない。しかも、キューブパズルは東寺のがらくた市で見つけて入手したということでなお嬉しくなった(注5)。
その同窓会での私の発表でもイントロでキューブパズルを使っていたこともあり、郷先生に、私のブログでさまざまな経路のパズルを紹介しています、と伝えていた。その際にお教えした3種類の経路のパズル(上記のパズルA~C)が、今回の論文の中でユニークな配列の例として実際に使われている。つまり、私自身もこの論文に少し影響を与えたというのは実に光栄なことである。
以上、このように複雑な事象を単純化して本質を抽出し、さらにそこから複雑な事象に洞察を与える、という研究を自らも進めてみたい。
注1:経路が別々のものや4×4×4の超難解なものをそこそこもっているだけではない。ラボには青色パズル(B)と同じ経路のものが教材として160個程度ある。東工大1年生向けに蛋白質フォールディング入門のような講義を担当しており、その際に生命理工学院1年生全員(150名程度)に一人一個ずつ配布してパズルで遊んでもらって蛋白質フォールディングの難しさを実感してもらっているのだ。10~15分ほどフォールディングにトライしてもらう(遊んでもらう)。「シャペロン」となってフォールディングを完成させる学生は1割に満たない。
注2:高田彰二「郷モデルの35年」 (生物物理 50(4),158-159,2010)に非常にわかりやすい解説がある。→無料pdfダウンロード
注3:ちなみにこのbが多いほど、すなわち折れ曲がりの数が多いほどパズルは一般に難解になる。すなわち、この三つの中で最も難しいパズルがC、最も簡単なのはBである。
注4:さきがけ研究の良かった一つは、同世代の関連研究者、領域総括を含めたシニア研究者(アドバイザー)が合宿形式で切磋琢磨するところだ。研究分野はそれほど近すぎないのもよかったし、領域終了後も貴重なネットワークとなっている。
| 東寺の紋(7量体リング。さらに内部に変性蛋白質) |
東寺はなんとフォールディングに関係することか!